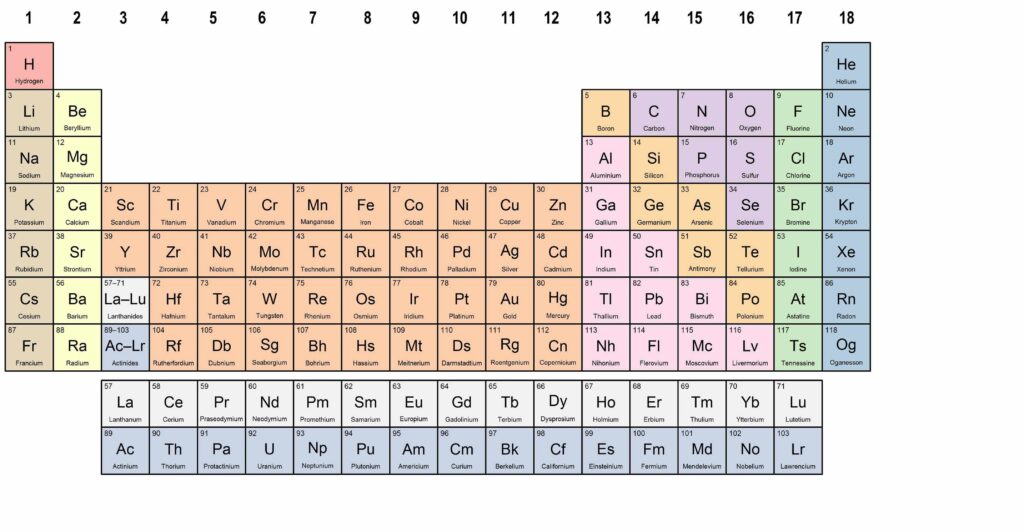
Het periodiek systeem
Het periodiek systeem is de belangrijkste tabel binnen de scheikunde. Het bevat alle bekende elementen, gerangschikt op volgorde van atoomnummer (het aantal protonen in de kern). Elementen met vergelijkbare eigenschappen staan onder elkaar in zogeheten groepen. Daarnaast geeft elk vakje in het periodiek systeem informatie over het element, zoals het symbool, de naam, het atoomnummer en vaak ook de molaire massa.
In de volgende vragen onderzoeken we stap voor stap hoe het periodiek systeem is opgebouwd en hoe je verbanden kunt leggen tussen de eigenschappen van verschillende elementen.

Vraag 1: Beschrijf de verschillende bekende groepen in het periodiek systeem.
Uitwerking:
Het periodiek systeem is opgedeeld in rijen (perioden) en kolommen (groepen). Elementen binnen dezelfde groep vertonen vergelijkbare chemische eigenschappen, omdat ze hetzelfde aantal elektronen in hun buitenste schil hebben.
- Groep 1 – De alkalimetalen:
Dit zijn zeer reactieve metalen, zoals lithium (Li), natrium (Na) en kalium (K). Ze hebben één elektron in hun buitenste schil, waardoor ze gemakkelijk reageren met andere elementen, vooral met water en halogenen. - Groep 2 – De aardalkalimetalen:
Deze groep bevat metalen zoals magnesium (Mg) en calcium (Ca). Ze zijn iets minder reactief dan de alkalimetalen en hebben twee elektronen in hun buitenste schil. - Groepen 3 t/m 12 – De overgangsmetalen:
Dit zijn metalen zoals ijzer (Fe), koper (Cu) en goud (Au). Ze hebben vaak meerdere mogelijke ladingen en worden veel gebruikt als geleiders en in legeringen. - Groep 17 – De halogenen:
Deze niet-metalen, zoals fluor (F), chloor (Cl) en jodium (I), zijn erg reactief. Ze komen in de natuur meestal niet in pure vorm voor, maar als verbindingen (zoals keukenzout: NaCl). - Groep 18 – De edelgassen:
Dit zijn helium (He), neon (Ne), argon (Ar) en andere gassen die bijna niet reageren met andere elementen. Hun buitenste elektronenmantel is volledig gevuld, waardoor ze chemisch stabiel zijn. - Andere belangrijke groepen:
– De metalloïden (zoals silicium) hebben zowel eigenschappen van metalen als niet-metalen.
– De niet-metalen bevinden zich rechts in de tabel en vormen meestal gassen of broze vaste stoffen.
– De lanthaniden en actiniden (onderaan de tabel) bevatten zeldzame aardmetalen en radioactieve elementen.
Het periodiek systeem is dus meer dan een lijst van elementen – het is een geordende weergave van de bouwstenen van de materie, waarbij de structuur direct samenhangt met de eigenschappen van elk element.
Vraag 2: Stel dat ik twee willekeurige elementen kan combineren, waarbij ik de protonen bij elkaar op kan tellen. Één van mijn atomen is stikstof. Wat is het lichtste atoom dat ik kan gebruiken om tot een edelgas te komen?
Uitwerking:
Stikstof (N) heeft een atoomnummer van 7, wat betekent dat het 7 protonen in de kern heeft. Edelgassen hebben de volgende atoomnummers:
![]()
We zoeken nu het lichtste element dat, wanneer we het combineren met stikstof, leidt tot een totaal aantal protonen dat gelijk is aan een edelgas.
We rekenen:
![]()
Het element met atoomnummer 3 is lithium (Li).
Controle:
![]()
Conclusie: Het lichtste atoom dat je met stikstof kunt combineren om tot een edelgas (neon) te komen, is lithium (Li).
Vraag 3: We weten dat waterstof (H) altijd één covalente binding vormt met een ander atoom in een neutraal molecuul. Wat zijn de drie lichtste atomen naast waterstof die ook meestal één covalente binding vormen?
Uitwerking:
Bij covalente bindingen delen atomen elektronen om een volle buitenste schil te krijgen. Waterstof heeft één elektron en wil er één bij — het vormt dus één gedeelde (covalente) binding.
De elementen die meestal ook één covalente binding vormen, zijn die met zeven elektronen in hun buitenste schil. Deze atomen hebben nog één elektron nodig om een stabiele octetstructuur te bereiken. Dit zijn de halogenen.
De drie lichtste halogenen zijn:
![]()
Elk van deze atomen deelt één elektron met een ander atoom, bijvoorbeeld in de moleculen HF, HCl en HBr.
Let op: stoffen als lithium (Li) en natrium (Na) hebben ook 1 elektron in hun buitenste schil. Dat kan je zien aan het feit dat ze in dezelfde kolom als waterstof staan. Het is voor deze stoffen vaak makkelijker om 1 elektron af te staan dan om de hele schil te vullen. Dit resulteert echter in een ionische binding, dus anders dan de covalente binding die wordt gevraagd.
Conclusie: De drie lichtste atomen naast waterstof die meestal één covalente binding vormen, zijn fluor (F), chloor (Cl) en broom (Br).
Samenvatting
Het periodiek systeem is niet zomaar een tabel, maar een overzicht van de fundamentele bouwstenen van alle materie. Door de ordening op basis van atoomnummer en elektronenstructuur kunnen we in één oogopslag veel afleiden over de eigenschappen en het gedrag van elk element.
We hebben gezien dat elementen binnen dezelfde groep zich vaak op vergelijkbare manieren gedragen, omdat ze hetzelfde aantal elektronen in hun buitenste schil hebben. Zo reageren de alkalimetalen heftig doordat ze gemakkelijk één elektron afstaan, terwijl de halogenen juist graag één elektron opnemen. De edelgassen zijn de uitzondering: hun buitenste schil is al volledig gevuld, waardoor ze vrijwel niet reageren.
Ook leerden we hoe de atoomnummers verband houden met de stabiliteit van elementen, en hoe het type binding – ionisch of covalent – bepaald wordt door de manier waarop atomen elektronen delen of afstaan.
Kortom, het periodiek systeem vormt het hart van de scheikunde: het verklaart niet alleen wat de elementen zijn, maar ook waarom ze zich gedragen zoals ze doen. Wie deze tabel begrijpt, begrijpt de logische samenhang van de chemische wereld.