pH-berekeningen
In deze blog behandelen we drie verschillende soorten pH-berekeningen:
- Bereken de pH van 0,020 M HCl.
- Bereken de pH van 0,020 M CH
 COOH (azijnzuur). Voor azijnzuur (CH
COOH (azijnzuur). Voor azijnzuur (CH COOH) geldt:
COOH) geldt: 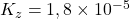 .
. - Je maakt een buffer door 50,0 mL 0,200 M azijnzuur (CH
 COOH) te mengen met 50,0 mL 0,200 M natriumacetaat (CH
COOH) te mengen met 50,0 mL 0,200 M natriumacetaat (CH COONa). Bereken de pH van de buffer.
COONa). Bereken de pH van de buffer.
a) pH van 0,020 M sterk zuur (HCl)
HCl is een sterk zuur, dat betekent dat het volledig uiteenvalt in water.
Hoe kun je dit weten? In BINAS tabel 49 staat HCl boven H![]() O
O![]() . Alles daarboven zijn sterke zuren, alles tussen H
. Alles daarboven zijn sterke zuren, alles tussen H![]() O
O![]() en H
en H![]() O in zijn zwakke zuren.
O in zijn zwakke zuren.
Voor een sterk zuur geldt dus:
![]()
![]()
Antwoord: pH = 1,70
b) pH van zwak zuur (azijnzuur)
Azijnzuur is een zwak zuur, het valt dus maar gedeeltelijk uiteen.
Dan geldt bij benadering:
![]()
Met ![]() en
en ![]() M:
M:
![]()
Daaruit volgt:
![]()
Antwoord: pH ![]() 3,2
3,2
c) Buffer van azijnzuur en natriumacetaat
Een buffer bestaat uit een zwak zuur (HA) samen met zijn geconjugeerde base (A![]() ).
).
Stap 1: Beginconcentraties
Eerst is het belangrijk om de concentraties van HA en A![]() te bepalen. Dat doen we door het beginvolume en de concentratie met elkaar te vermenigvuldigen.
te bepalen. Dat doen we door het beginvolume en de concentratie met elkaar te vermenigvuldigen.
We mengen:
![]()
![]()
Totale volume:
![]()
Mollen:
![]()
![]()
Concentraties na mengen:
![]()
![]()
Stap 2: Gebruik de zuurconstante
Voor azijnzuur geldt:
![]()
De algemene formule is:
![]()
Omdat ![]() , is de breuk gelijk aan 1:
, is de breuk gelijk aan 1:
![]()
Dus:
![]()
Stap 3: Bereken de pH
![]()
Antwoord: pH ![]() 4,74
4,74