Ionen en zouten
Veel stoffen om ons heen zijn zouten – verbindingen die zijn opgebouwd uit positief en negatief geladen deeltjes, ook wel ionen genoemd. Keukenzout, krijt en gips zijn daar allemaal voorbeelden van.
In deze oefenopgaven ga je leren hoe je:
- de molecuulformule van een zout kunt bepalen door de ladingen van de ionen te combineren
- oplosreacties en neerslagreacties van zouten kunt opschrijven
Hierbij gebruik je BINAS tabel 32, waarin de belangrijkste ionen en hun oplosbaarheid staan vermeld. Een belangrijke regel om te onthouden: een zoutmolecuul is altijd elektrisch neutraal – de positieve en negatieve ladingen heffen elkaar precies op.
Opgave 1
Geef de molecuulformules van Natriumfosfaat, Calciumchloride, Magnesiumoxide
Gebruik hiervoor BINAS tabel 32. Hierin staan de belangrijke ionen waaruit de zouten bestaan.
Zouten bestaan altijd uit positieve en negatieve ionen. Samen heffen ze elkaars lading op. Het eindresultaat heeft altijd een totale neutrale lading, omdat een molecuul niet positief of negatief geladen kan zijn.
Wanneer dat wel zo zou zijn, zou het reageren met andere ionen totdat het neutraal is.
Uitwerking:
- Natriumfosfaat: bestaat uit Na
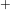 en PO
en PO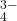 .
.
Om een neutraal zout te krijgen heb je drie Na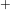 -ionen nodig per fosfaation.
-ionen nodig per fosfaation.
Molecuulformule: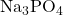
- Calciumchloride: calcium heeft lading
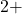 en chloride
en chloride  .
.
Om een neutraal zout te krijgen zijn twee chloride-ionen nodig per calciumion.
Molecuulformule: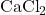
- Magnesiumoxide: magnesium heeft lading
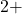 en oxide
en oxide 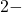 .
.
Eén ion van elk is voldoende om neutraal te worden.
Molecuulformule: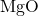
Opgave 2
Geef de oplosreactie van keukenzout in water
Keukenzout (NaCl) valt uiteen in natrium- en chloride-ionen.
![]()
- (s) = solid, dus vaste stof.
- (aq) = aqueous, opgelost in water.
Niet alle zouten lossen goed op. Wanneer je twee oplossingen mengt, kan er een slecht oplosbaar zout (neerslag) ontstaan. Dit check je in tabel BINAS 32.
Opgave 3
Geef de neerslagreactie met zilvernitraat en keukenzout
Vraag: Welke neerslag ontstaat als je oplossingen van AgNO![]() en NaCl mengt? Schrijf de reactievergelijking op.
en NaCl mengt? Schrijf de reactievergelijking op.
Volgens de oplosbaarheidstabel (BINAS 32) is AgCl slecht oplosbaar. Zilverionen en chloride-ionen vormen dus een neerslag:
![]()